Sumário
ToggleIntrodução

Primeiramente, para facilitar a compreensão dos próximos assuntos, colocamos essa aula que fala especificamente de dois assuntos, o Conceito formal de SISTEMA e O ESTADO DE AGREGAÇÃO das substâncias.
Precipuamente, em Química, um sistema é definido como qualquer porção do universo que se deseja estudar ou analisar. Pode ser tão simples quanto um sistema contendo uma única substância ou tão complexo quanto um sistema envolvendo múltiplas substâncias em diferentes estados de agregação. O conceito de sistema é essencial para descrever, assim como, entender as interações entre os componentes de uma amostra de matéria.
Tipos de sistemas
Existem dois tipos principais de sistemas na Química: abertos e fechados. Um sistema aberto permite a troca de matéria e energia com o ambiente externo, enquanto um sistema fechado permite apenas a troca de energia, mantendo constante a quantidade de matéria. Por exemplo, um copo de água aberto está sujeito a evaporação, uma forma de troca de matéria com o ambiente externo, enquanto um recipiente selado contendo água é um sistema fechado, onde a quantidade de água permanece constante, mas a temperatura pode variar.
Além disso, os sistemas podem ser classificados com base no número de fases presentes. Um sistema monofásico contém uma única fase, enquanto um sistema multifásico contém duas ou mais fases distintas. Por exemplo, uma mistura de água e gelo é um sistema bifásico, por conter tanto água líquida quanto gelo sólido, duas fases diferentes da água.
IMPORTANTE: O sistema composto por substâncias tem propriedades constantes. No caso das misturas, as propriedades não são constantes. Os componentes do sistema de uma substância consistem nas mesmas entidades. Nas misturas, a constituição não é a mesma, ou seja, as entidades que compõem o sistema não são as mesmas.
Estado de agregação da matéria.
O estado de agregação da matéria refere-se à forma como as partículas que compõem uma substância estão organizadas, assim como, interagem entre si. De fato, existem três estados de agregação principais: sólido, líquido e gasoso. Cada um desses estados possui características únicas, determinadas pela intensidade das forças intermoleculares, bem como, pela energia cinética das partículas.
O estado sólido é caracterizado pela organização regular e próxima das partículas, resultando em uma forma e volume definidos. Porque as forças intermoleculares são fortes o suficiente para manter as partículas em posições fixas, conferindo rigidez à substância. Exemplos comuns de substâncias no estado sólido incluem metais, minerais e compostos iônicos.

Já o estado líquido é caracterizado pela organização menos ordenada das partículas e pela capacidade de fluir e, do mesmo modo, assumir a forma do recipiente que o contém, mantendo um volume constante. Pois, as forças intermoleculares no estado líquido são mais fracas do que no estado sólido, permitindo que as partículas se movam livremente umas em relação às outras. Por exemplo, substâncias como água, álcool e óleo podem ser encontradas no estado líquido.

Por fim, o estado gasoso é caracterizado pela alta energia cinética das partículas e pela ausência de forças intermoleculares significativas. Pois, as partículas no estado gasoso estão em constante movimento e ocupam todo o volume disponível do recipiente que as contém. Gases como oxigênio, nitrogênio e, do mesmo modo, o dióxido de carbono são exemplos comuns de substâncias no estado gasoso.

Ponto triplo
O ponto triplo é uma condição especial onde os três estados de uma mesma substância coexistem em um sistema em uma temperatura e pressão específica.
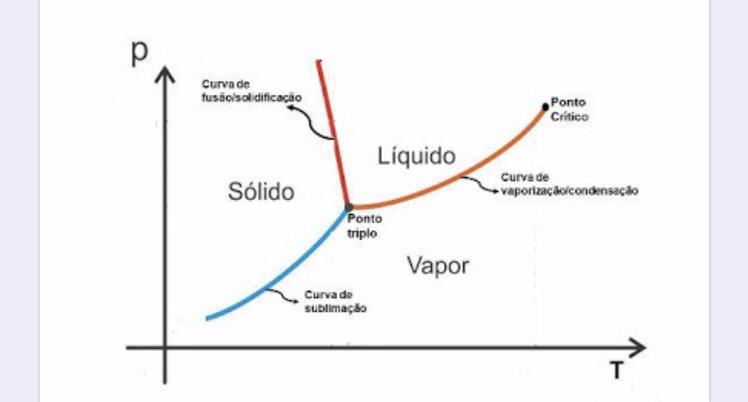
A compreensão dos estados de agregação da matéria é fundamental para explicar uma série de fenômenos e processos químicos, desde a evaporação de uma substância líquida até a sublimação de um sólido. Além disso, a transição entre os diferentes estados de agregação é conhecida como mudança de fase.
Exercícios de 1 a 4
1 – Qual é a definição de sistema na Química?
a) Uma reação química.
b) Uma substância pura.
c) Qualquer porção do universo que se deseja estudar ou analisar.
d) Uma mistura homogênea.
e) Uma substância composta.
2 – O que caracteriza um sistema aberto?
a) Troca de matéria com o ambiente externo.
b) Troca de energia com o ambiente externo.
c) Manutenção constante da quantidade de matéria.
d) Presença de múltiplas fases.
e) Ausência de interações com o ambiente externo.
3 – Como classificamos um sistema que contém mais de uma fase?
a) Monofásico.
b) Multifásico.
c) Isolado.
d) Homogêneo.
e) Heterogêneo.
4 – O que caracteriza um sistema fechado?
a) Troca de matéria com o ambiente externo.
b) Troca de energia com o ambiente externo.
c) Manutenção constante da quantidade de matéria.
d) Presença de múltiplas fases.
e) Ausência de interações com o ambiente externo.
Exercícios de 5 a 8
5 – Qual é a principal característica do estado sólido?
a) Volume variável.
b) Partículas em movimento constante.
c) Forma e volume definidos.
d) Ausência de forças intermoleculares.
e) Capacidade de fluir e assumir a forma do recipiente.
6 – O que caracteriza o estado líquido?
a) Organização regular das partículas.
b) Alta energia cinética das partículas.
c) Capacidade de ocupar todo o volume disponível.
d) Rigidez da substância.
e) Capacidade de assumir a forma do recipiente.
7 – Qual é a principal diferença entre o estado líquido e o estado gasoso?
a) Energia cinética das partículas.
b) Volume constante.
c) Forma definida.
d) Forças intermoleculares.
e) Capacidade de fluir.
8 – O que define o estado gasoso?
a) Organização regular das partículas.
b) Alta energia cinética das partículas.
c) Capacidade de manter a forma do recipiente.
d) Volume e forma definidos.
e) Rigidez da substância.
Respostas: 1-c, 2-a, 3-b, 4-c, 5-c, 6-e, 7-b, 8-b

