Sumário
ToggleIntrodução
O modelo atômico de Niels Bohr, proposto em 1913, integrou os conceitos emergentes da física quântica da época e foi uma resposta direta às deficiências do modelo de Rutherford. Bohr expandiu as ideias básicas da estrutura atômica com uma abordagem que solucionava o problema do colapso atômico, que seria inevitável sob as leis da física clássica aplicadas ao modelo de Rutherford. Exploraremos mais detalhadamente esse tópico para enriquecer o seu material de preparação para concursos públicos na área de Química.
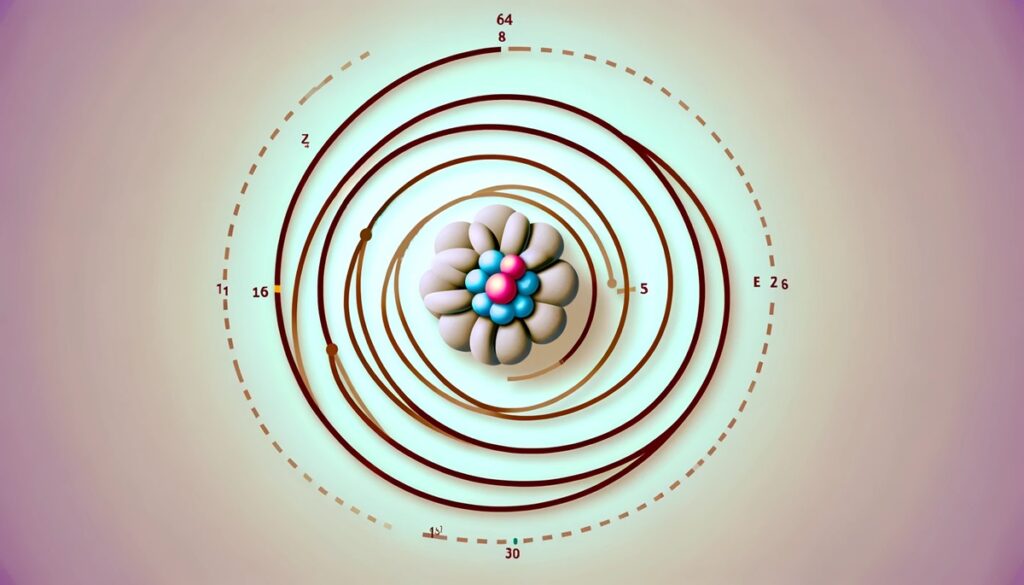
O modelo atômico desenvolvido por Rutherford.
Ernest Rutherford havia proposto o modelo do átomo antes de Bohr. Ele era semelhante a um pequeno sistema solar com elétrons orbitando um núcleo central carregado positivamente. Isso é semelhante ao movimento de planetas em torno do sol. No entanto, este modelo enfrentava um grave problema teórico: consoante as leis da física clássica, especialmente a eletrodinâmica, qualquer partícula carregada em movimento circular deveria emitir energia continuamente na forma de radiação eletromagnética. Isso levaria os elétrons a perder energia gradualmente e, eventualmente, espiralar para dentro e colidir com o núcleo, levando ao colapso atômico.

Introdução ao modelo de Bohr
Niels Bohr, físico dinamarquês, após estudar o espectro do átomo de hidrogênio e aplicar conceitos da teoria quântica, propôs em 1913 um modelo atômico revolucionário. Neste modelo, os elétrons ocupam órbitas específicas ao redor do núcleo, conhecidas como ‘órbitas estacionárias’. A diferença de energia entre essas órbitas, chamadas níveis quânticos, explica por que os elétrons não emitem energia enquanto permanecem em uma órbita específica.

Obviamente, o elétron poderia emitir energia, mas somente em duas condições bem peculiares. Não apenas quando ele recebesse energia e devido a estar mais energético, ele passaria para outro orbital mais energético, mas também, quando ele emitisse energia, passando para um orbital menos energético. O interessante é a relação entre a energia absorvida/liberada, a relação está no nome, para a mudança de nível quântico, ou o elétron absorve, ou libera quanta.
Implicações do modelo de Bohr
Quantização de energia
O conceito de quantização de energia no nível atômico foi introduzido pelo modelo de Bohr. Foi uma noção revolucionária na época e foi fundamental para o desenvolvimento posterior da mecânica quântica.
Estabilidade do átomo
Bohr explicou a estabilidade dos átomos, que não colapsam apesar dos elétrons estarem em constante movimento, porque eles ocupam órbitas estacionárias de energia definida.
Espectros atômicos:
O modelo conseguia explicar os espectros de emissão, bem como, de absorção de hidrogênio com grande precisão, algo que o modelo de Rutherford não conseguia. Pois, cada transição entre as órbitas permitidas corresponde a uma linha específica no espectro do hidrogênio.
Limitações e desenvolvimentos subsequentes
Apesar de seu sucesso inicial, o modelo de Bohr tinha limitações. Ele funcionava bem para átomos com um único elétron, como o hidrogênio, mas falhava ao tentar explicar os espectros de átomos mais complexos com múltiplos elétrons. Eventualmente, o modelo foi superado pela mecânica quântica moderna, que oferece uma descrição mais geral e poderosa dos átomos e partículas subatômicas.
Expansão do modelo de Bohr e desenvolvimentos subsequentes
Após Niels Bohr introduzir seu modelo atômico em 1913, novas descobertas e teorias foram propostas para aprimorar a compreensão da estrutura atômica e dos fenômenos quânticos associados.
Interpretação dos espectros e subníveis energéticos
Bohr percebeu que cada tipo de radiação interage com uma parte específica da matéria, relacionada diretamente com a frequência da radiação. Decerto, esta observação levou Bohr a concluir que os elétrons não interagem com todas as formas de radiação, uma ideia que o levou a formular postulados específicos sobre a organização dos elétrons em um átomo.
Primeiro Postulado de Bohr: Os elétrons estão dispostos em níveis estacionários de energia ao redor do núcleo.
Segundo Postulado de Bohr: Os elétrons ocupam estes níveis definidos; eles não existem entre os níveis, movendo-se em um nível sem ganhar ou perder energia. Portanto, a transição de um elétron de um nível para outro, resulta em ganho ou perda de energia, manifestada como raias espectrais observadas nos espectros atômicos.
Avanços de Sommerfeld e de Broglie
Em 1916, Arnold Sommerfeld expandiu o modelo de Bohr ao introduzir órbitas elípticas, assim como, diferentes momentos angulares, propondo a existência de subníveis nos principais níveis de energia. Aliás, ele utilizou espectroscopia de alta resolução para identificar múltiplas linhas espectrais justapostas, introduzindo o conceito de número quântico secundário, conhecido como subníveis de energia.
Em 1924, Louis de Broglie apresentou a teoria da dualidade onda-partícula da matéria, afirmando que todas as partículas de qualquer material possuem não apenas características de ondas, mas também, de partículas. Esta teoria foi fundamental para o desenvolvimento do princípio da incerteza de Werner Heisenberg em 1927, que afirmava ser impossível determinar simultaneamente a posição exata, assim como, a velocidade de um elétron.
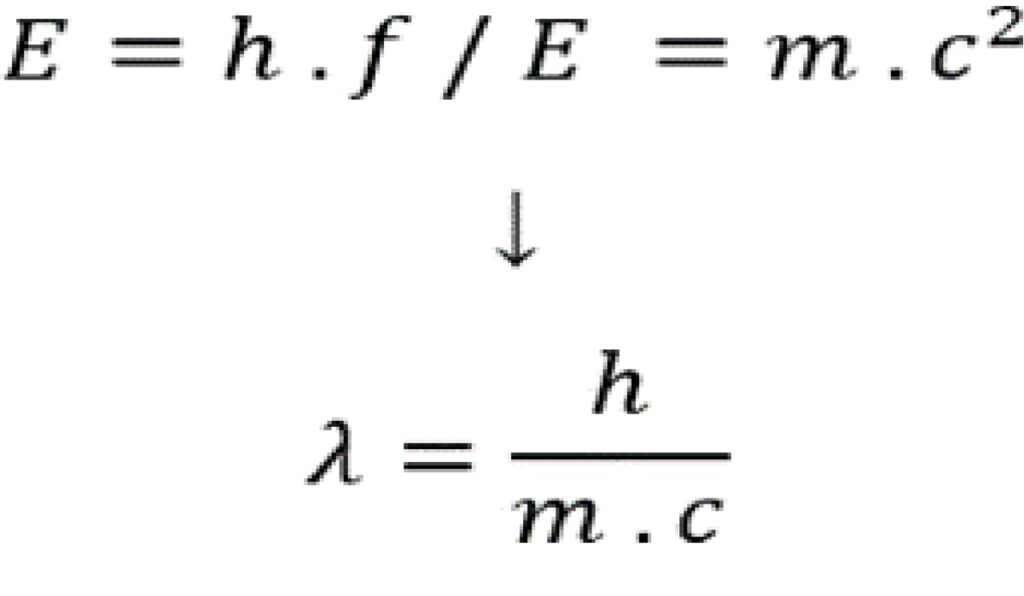
Equação de Schrödinger e orbitais atômicos.
Utilizando as ideias de Broglie e, do mesmo modo, as de Heisenberg, Erwin Schrödinger desenvolveu uma equação matemática em 1926 que descreve a distribuição de elétrons em átomos. Assim, a solução desta equação produz funções de onda que definem os orbitais atômicos, áreas em um átomo onde há maior probabilidade de encontrar um elétron.
Contribuições de Hund e Pauli
Friedrich Hermann Hund, em 1927, formulou a Regra de Hund, que influencia como os elétrons são distribuídos entre os orbitais de mesmo subnível, promovendo uma configuração com a menor repulsão inter eletrônica possível.
Conclusão
O estudo da estrutura atômica, bem como, o da mecânica quântica continuou a evoluir após Bohr, Sommerfeld, de Broglie, Heisenberg, Schrödinger, Hund e Pauli. Pois, cada contribuição adicionou camadas de compreensão e refinou nossos modelos de como os elétrons são organizados e se comportam em átomos. Este entendimento não apenas fundamenta a teoria química moderna, mas também impulsiona inovações em campos como nanotecnologia, eletrônica e materiais.
Exercícios de 1 a 4 – modelo atômico de Bohr e outros
Questão 1
Qual problema do modelo de Rutherford o modelo de Bohr teve em vista resolver?
a) A localização precisa dos elétrons
b) A estabilidade do átomo evitando o colapso atômico
c) A natureza dual dos elétrons
d) A forma elíptica das órbitas dos elétrons.
Questão 2
O que caracteriza uma “órbita estacionária” segundo Bohr?
a) Um estado no qual os elétrons podem emitir energia sem mudar de órbita
b) Uma órbita onde o elétron não emite nem absorve energia
c) Uma posição no átomo onde a energia do elétron é máxima
d) Um nível onde o elétron interage com a radiação eletromagnética.
Questão 3
Qual foi uma contribuição significativa do modelo de Bohr para o desenvolvimento da física quântica?
a) Introdução da ideia de quantização de energia
b) Proposta da equação de Schrödinger
c) Desenvolvimento do princípio da incerteza
d) Formulação da teoria da relatividade.
Questão 4
Como o modelo de Bohr explica os espectros de emissão e absorção do hidrogênio?
a) Através da variação contínua de energia dos elétrons
b) Mediante a transição de elétrons entre órbitas com diferentes energias
c) Por meio da difusão de elétrons para níveis de energia mais altos sem emitir energia
d) Utilizando o conceito de movimento elíptico dos elétrons.
Exercícios de 5 a 8 – modelo atômico de Bohr e outros
Questão 5
Qual foi a principal limitação do modelo de Bohr?
a) Não explicava a estabilidade dos átomos
b) Não podia descrever átomos com mais de um elétron
c) Era incapaz de prever os estados excitados dos elétrons
d) Não utilizava matemática suficiente para ser preciso.
Questão 6
Que avanço Arnold Sommerfeld adicionou ao modelo de Bohr?
a) Introduziu a ideia de órbitas elípticas e subníveis de energia
b) Propôs a dualidade onda-partícula dos elétrons
c) Desenvolveu a teoria da relatividade especial
d) Explicou a mecânica estatística quântica.
Questão 7
Qual é o impacto da teoria da dualidade onda-partícula proposta por Louis de Broglie?
a) Explicou o comportamento das partículas subatômicas apenas como partículas
b) Sugeriu que todas as partículas materiais têm características de ondas
c) Limitou o entendimento do comportamento dos elétrons a órbitas fixas
d) Eliminou a necessidade de quantização em física quântica.
Questão 8
Como a equação de Schrödinger contribui para a compreensão dos átomos?
a) Proporcionou um método para calcular a trajetória precisa dos elétrons
b) Descreveu as funções de onda que definem os orbitais atômicos
c) Fornecia uma descrição clássica dos movimentos dos elétrons
d) Simplificou o modelo atômico para formas geométricas básicas.
Respostas: 1-b, 2-b, 3-a, 4-b, 5-b, 6-a, 7-b, 8-b

