Sumário
ToggleIntrodução
Primeiramente, o conceito de raio atômico é fundamental na química, especialmente para estudantes se preparando para vestibulares e o ENEM. Exploraremos a definição, as técnicas de medição, bem como, as variações do raio atômico na tabela periódica, fornecendo, de maneira rápida e objetiva, uma compreensão aprofundada dos elementos químicos.

Definição e medição do raio atômico
O raio atômico é definido como a distância do centro do núcleo de um átomo até a sua camada eletrônica externa, ou seja, a sua última camada. Essa medida não é fixa, variando conforme a ligação que o átomo esteja fazendo e o número de elétrons. A medição mais comum do raio atômico é feita através da difração de raios-x, uma técnica que permite determinar a estrutura cristalina, assim como, as distâncias interatômicas com alta precisão. Esse método facilita o entendimento de como os átomos se ligam e formam compostos.
Imagem
Exemplo fácil:
Por exemplo, o hidrogênio, o elemento mais simples, com um único elétron em sua única camada. Em suma, determinação do seu raio atômico é direta, você não precisa criar teorias mirabolantes, ele tem um elétron, uma camada e na sua condição mais simples (exceto o deutério e o trítio), um próton. Basicamente, uma medição ponta a ponta.
Exemplo médio:
O cálcio, localizado no grupo 2, tem seu raio atômico medido considerando suas interações em estruturas cristalinas comuns, como o carbonato de cálcio. Aliás, no caso de elementos com mais de dois elétrons, a complexidade aumenta.
Exemplo difícil:
O urânio, um elemento pesado, assim como, radioativo, apresenta desafios únicos na medição do raio atômico devido à sua complexa estrutura eletrônica, além da radioatividade inerente.
Variação do raio atômico na tabela periódica
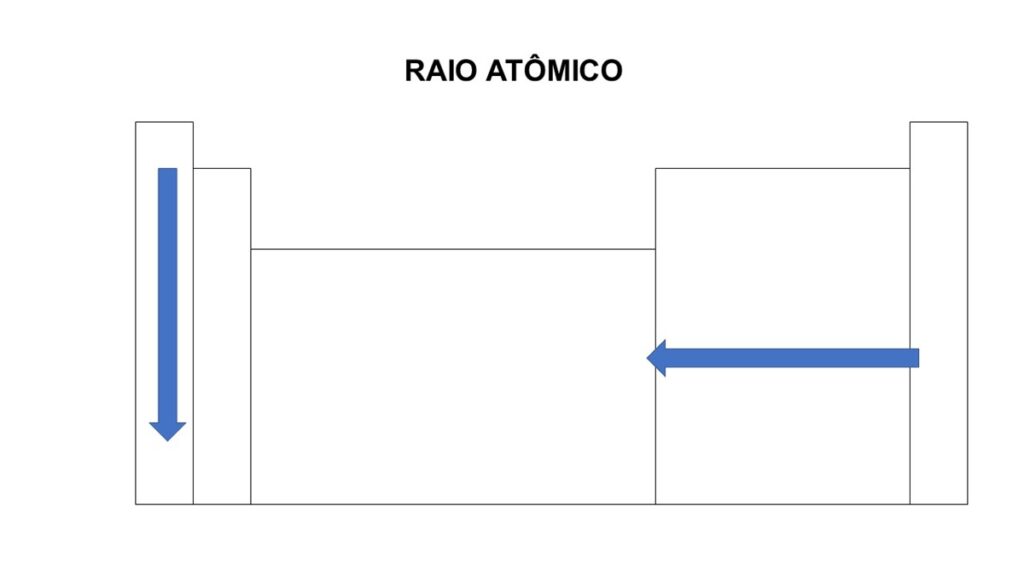
O raio atômico dos elementos exibe tendências distintas na tabela periódica. Quando você observa somente o grupo, o raio aumenta de cima para baixo devido ao acréscimo de camadas eletrônicas. Em contrapartida, quando você considera somente o período, o raio diminui da esquerda para a direita, pois o aumento do número atômico e a consequente maior atração do núcleo pelos elétrons reduzem o tamanho do átomo.
O raciocínio é bem simples, quanto maior a quantidade de cargas positivas no núcleo, maior a Força Elétrica gerada, aproximando ainda mais as camadas eletrônicas.
Exemplo fácil:
Nos metais alcalinos, como lítio e potássio, observa-se um aumento significativo do raio atômico ao descer no grupo, porque quanto mais se desce no grupo, mais camadas são adicionadas.
Exemplo médio:
Nos calcogênios (família ou grupo do oxigênio), como oxigênio e o telúrio, a variação do raio atômico reflete a adição de elétrons em subníveis mais externos e o aumento da blindagem eletrônica, ou seja, quando o oxigênio ou qualquer outro elemento da do seu grupo ganha elétrons, o raio atômico aumenta.
Exemplo difícil:
Na transição do escândio para o zinco, por exemplo, a redução do raio atômico ilustra o efeito de blindagem ineficaz dos elétrons d, mesmo com o aumento do número de prótons.
*Efeito de blindagem é a redução da força de atração do núcleo sobre os elétrons de valência devido à presença de outros elétrons entre eles e o núcleo.
Conclusão
Em suma, entender o que é o raio de um átomo, como é sua variação e comportamento na tabela periódica, pode aumentar o seu preparado para vestibulares em geral. Contudo, não esquecendo que muitos conceitos complexos, muitas questões tidas como difíceis, nada mais são do que o conceito de fácil entendimento ou aplicação, trabalhado de maneira mais complexa. Bons estudos e não deixe de se preparar.
“Não existe sorte, existe preparo, mais preparo e ainda mais preparo. A sorte é o reflexo de um preparo árduo e consistente.”
Questões objetivas sobre o raio atômico – 1 a 4
Questão 1:
Qual técnica é comumente utilizada para medir o raio atômico de elementos, especialmente em compostos cristalinos?
A) Espectroscopia de absorção
B) Microscopia eletrônica
C) Difração de raios-x
D) Cromatografia
E) Ressonância magnética nuclear
Questão 2:
Como o raio atômico varia em um grupo ou família na tabela periódica?
A) Diminui de cima para baixo
B) Aumenta de cima para baixo
C) Permanece constante
D) Aumenta de baixo para cima
E) Não apresenta variação regular
Questão 3:
Por que o raio atômico diminui da esquerda para a direita em um período na tabela periódica?
A) Devido ao aumento do número de prótons que aumenta a atração sobre os elétrons
B) Porque o número de elétrons diminui
C) Devido à diminuição do número de nêutrons
D) Porque a quantidade de energia nuclear aumenta
E) Devido à diminuição da blindagem eletrônica
Questão 4:
Qual é a principal razão para o aumento do raio de um átomo ao descer em um grupo da tabela periódica?
A) Redução do número de elétrons
B) Aumento da repulsão eletrônica entre os elétrons
C) Acréscimo de camadas eletrônicas
D) Diminuição do número de prótons
E) Aumento da energia cinética dos elétrons
Questões objetivas sobre o raio atômico – 5 a 8
Questão 5:
Qual desafio é associado à medição do raio atômico do urânio?
A) Sua baixa reatividade química
B) Sua estabilidade isotópica
C) Efeitos de contração dos lantanídeos
D) Sua abundância natural
E) Sua inércia química
Questão 6:
Como o raio atômico do oxigênio compara-se ao do telúrio dentro do mesmo grupo?
A) O oxigênio tem um raio maior devido à menor atração nuclear.
B) O telúrio tem um raio maior devido ao aumento de camadas eletrônicas.
C) Ambos têm raios atômicos iguais.
D) O oxigênio tem um raio maior devido ao seu maior número de elétrons.
E) O telúrio tem um raio menor devido à sua maior massa atômica.
Questão 7:
Qual fenômeno explica a redução do raio atômico do escândio para o zinco em um período?
A) Aumento da blindagem eletrônica
B) Diminuição da blindagem eletrônica
C) Blindagem ineficaz dos elétrons d
D) Aumento do número de camadas eletrônicas
E) Redução do número de prótons
Questão 8:
No contexto do estudo do raio de um átomo, por que é importante entender as variações em um período?
A) Porque, para prever reações químicas baseadas na reatividade dos elementos
B) Para determinar a condutividade elétrica dos elementos
C) Para associar propriedades físicas como ponto de fusão e ebulição
D) Para explicar as tendências de ionização e afinidade eletrônica
E) Todas as respostas acima são corretas
Respostas questões objetivas
1-C, 2-B, 3-A, 4-C, 5-C, 6-B, 7-C, 8-E

