Sumário
ToggleIntrodução

O grau de pureza de uma substância refere-se à sua concentração de componentes ativos em relação a impurezas presentes. Em geral, quanto maior o grau de pureza de uma substância, mais uniforme e previsível será o comportamento de suas propriedades físicas. Por exemplo, considere o caso do ponto de fusão e do ponto de ebulição. Substâncias com alto grau de pureza tendem a apresentar pontos de fusão e ebulição mais nítidos e definidos, em comparação com substâncias impuras. Isso ocorre porque as impurezas presentes em uma substância interferem nas forças intermoleculares entre suas moléculas, resultando em uma ampla faixa de temperatura de transição de fase.
Além disso, o grau de pureza também pode afetar outras propriedades físicas, como densidade, condutividade elétrica, índice de refração e solubilidade. Em geral, substâncias com alto grau de pureza tendem a exibir essas propriedades de forma mais consistente e previsível, facilitando sua caracterização (análise) e aplicação em diversas áreas, como indústria, medicina e pesquisa científica.
2. Aplicações práticas:
Na indústria farmacêutica, a pureza de um medicamento pode afetar sua biodisponibilidade (refere-se como um fármaco (princípio ativo de um medicamento) é absorvido pelo organismo vivo e atinge o seu ponto de ação, considerando a velocidade e a concentração) e eficácia terapêutica. Portanto, é essencial garantir que os medicamentos sejam produzidos com alto grau de pureza para garantir sua qualidade e segurança.
Da mesma forma, na indústria de semicondutores, a pureza dos materiais utilizados na fabricação de chips e dispositivos eletrônicos é fundamental para garantir o desempenho e a confiabilidade dos produtos finais. Visto que, impurezas presentes em materiais semicondutores podem afetar negativamente a condutividade elétrica e a eficiência dos dispositivos, resultando em falhas de funcionamento e perda de produtividade.
Além disso, na pesquisa científica, a pureza das substâncias é essencial para obter resultados confiáveis e reproduzíveis. Experimentos realizados com substâncias impuras podem levar a conclusões equivocadas e interpretações errôneas dos dados experimentais, comprometendo a validade das descobertas científicas.
3. Correlação com propriedades definidas, determinadas e invariáveis:

3.1 Propriedades definidas:
As propriedades definidas são características intrínsecas das substâncias que podem ser usadas para identificar e distinguir uma substância específica de outras. Exemplos de propriedades definidas incluem ponto de fusão, ponto de ebulição, densidade, solubilidade e condutividade elétrica. Essas propriedades são características únicas de cada substância e não mudam, desde que as condições ambientais permaneçam constantes. Por exemplo, o ponto de fusão da água é sempre (0 °C) e seu ponto de ebulição é sempre (100 °C), desde que a pressão atmosférica permaneça constante ao nível do mar.
3.2 Propriedades determinadas:
As propriedades determinadas são aquelas que podem ser medidas experimentalmente com precisão. Elas são determinadas por meio de técnicas de medição e análise. Exemplos de propriedades determinadas incluem massa, volume, pressão e temperatura. Essas propriedades podem variar segundo as condições externas, como pressão e temperatura, mas são características intrínsecas da substância em questão. Por exemplo, a massa de uma amostra de ouro sempre será a mesma, independentemente de seu estado físico ou de sua localização no universo.
3.3 Propriedades invariáveis:
As propriedades invariáveis são aquelas que não mudam, independentemente das condições externas. Essas propriedades são fundamentais para a identificação e caracterização de substâncias. Exemplos de propriedades invariáveis incluem a composição química, a estrutura molecular e as proporções dos elementos constituintes. Essas características são únicas para cada substância e permanecem constantes, mesmo quando a substância passa por mudanças de estado físico ou é submetida a diferentes condições ambientais.
Importante destacar que as análise de substâncias ou misturas se baseiam nessas três propriedades. Outro ponto importante é que toda análise nada mais é do que a comparação com um padrão já estabelecido. Por exemplo, quando analisamos um líquido incolor, inodoro, que pesa 1g por ml a 6 °C e possui temperatura de fusão de 0 °C e ebulição a 100 °C, podemos dizer que estamos falando da água.
Agora abordaremos um assunto muito cobrado nas provas de concurso e vestibulares em geral, os quais são as misturas eutéticas e azeotrópicas.
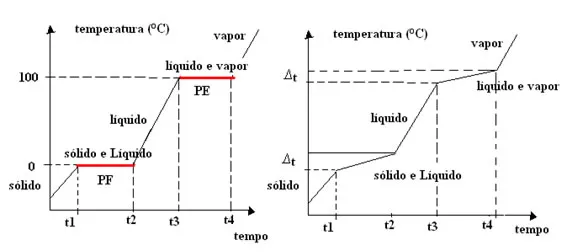
4. Misturas eutéticas:
Uma mistura eutética é uma mistura de duas ou mais substâncias que exibe um ponto de fusão mais baixo do que qualquer um de seus componentes individuais. Isso ocorre quando as substâncias se combinam em proporções específicas, resultando em uma diminuição da temperatura de fusão da mistura. Um exemplo comum de mistura eutética é a combinação de sal de cozinha (cloreto de sódio) e gelo, que forma uma solução com ponto de fusão abaixo de 0 °C. As misturas eutéticas são importantes em diversas aplicações industriais, como soldagem, metalurgia e produção de ligas metálicas.
Na prática, a temperatura do ponto de fusão é constante, sendo variável somente a temperatura de ebulição.
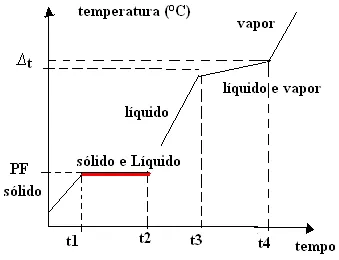
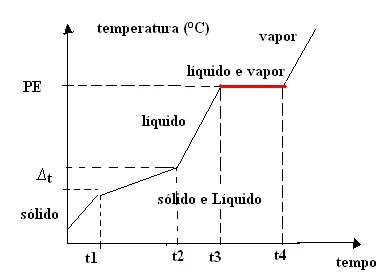
5. Misturas azeotrópicas:
Primeiramente, uma mistura azeotrópica é uma mistura de líquidos que mantém uma composição constante durante o processo de destilação, produzindo um vapor com a mesma composição que o líquido original. De fato, isso ocorre quando as substâncias na mistura formam uma mistura homogênea que não pode ser separada por destilação simples. Um exemplo comum de mistura azeotrópica é a mistura de etanol e água, que forma uma solução com ponto de ebulição constante, conhecida como álcool etílico anidro. As misturas azeotrópicas são importantes na indústria de destilação de bebidas alcoólicas e na produção de combustíveis.
Na prática, a temperatura do ponto de ebulição é constante, sendo variável somente a temperatura de fusão.
Exercícios 1 a 4
1 – O que caracteriza uma mistura eutética?
a) Ponto de fusão mais alto que qualquer um de seus componentes.
b) Composição variável durante o processo de destilação.
c) Diminuição da temperatura de fusão em relação aos componentes individuais.
d) Formação de um vapor com composição diferente do líquido original.
e) Incompatibilidade entre os componentes.
2 – Qual é a principal característica de uma mistura azeotrópica?
a) Ponto de fusão constante.
b) Composição variável durante a destilação.
c) Elevação da temperatura de ebulição em relação aos componentes.
d) Composição variável durante o processo.
e) Manutenção da composição constante no vapor.
3 – Por que as misturas eutéticas são importantes na indústria?
a) Porque formam uma mistura homogênea.
b) Porque têm um ponto de fusão mais alto que os componentes.
c) Porque têm um ponto de fusão mais baixo que os componentes.
d) Porque são facilmente separadas por destilação.
e) Porque têm uma composição variável durante a destilação.
4 – O que ocorre durante a destilação de uma mistura azeotrópica?
a) Formação de um vapor com composição diferente do líquido original.
b) Diminuição da temperatura de ebulição em relação aos componentes.
c) Elevação da temperatura de ebulição em relação aos componentes.
d) Formação de um vapor com a mesma composição do líquido original.
e) Facilidade de separação por destilação simples.
Exercícios de 5 a 8

5 – Qual é o principal efeito do grau de pureza em relação ao ponto de fusão e ponto de ebulição das substâncias?
a) Não há efeito do grau de pureza nessas propriedades.
b) Substâncias com baixo grau de pureza têm pontos de fusão e ebulição mais nítidos.
c) O grau de pureza não afeta o comportamento das propriedades de fusão e ebulição.
d) Substâncias com alto grau de pureza tendem a apresentar pontos de fusão e ebulição mais definidos.
e) Substâncias com alto grau de pureza têm pontos de fusão e ebulição mais amplos.
6 – Como a presença de impurezas pode afetar as propriedades físicas das substâncias?
a) Impurezas aumentam a densidade das substâncias.
b) Impurezas aumentam a solubilidade das substâncias.
c) Impurezas tornam as propriedades físicas mais uniformes.
d) Impurezas interferem nas forças intermoleculares e ampliam a faixa de temperatura de transição de fase.
e) Impurezas diminuem a condutividade elétrica das substâncias.
7 – Por que a pureza dos materiais é fundamental na indústria de semicondutores?
a) Porque não há impurezas nos materiais semicondutores.
b) Porque a presença de impurezas não afeta a condutividade elétrica dos semicondutores.
c) Porque impurezas podem afetar negativamente o desempenho e a confiabilidade dos dispositivos eletrônicos.
d) Porque a pureza dos materiais semicondutores é necessária apenas para pesquisa científica.
e) Porque impurezas aumentam a eficiência dos dispositivos eletrônicos.
8 – Qual é a importância da pureza das substâncias na pesquisa científica?
a) Não há relação entre pureza das substâncias e pesquisa científica.
b) A pureza das substâncias não afeta a validade dos resultados experimentais.
c) A pureza das substâncias é essencial para garantir a reprodução confiável dos resultados experimentais.
d) A presença de impurezas melhora a precisão dos resultados experimentais.
e) A pureza das substâncias não influencia na interpretação dos dados experimentais.
Exercícios de 9 a 12
9 – Qual é a definição de uma mistura segundo o texto?
a) Uma combinação química de duas ou mais substâncias.
b) Uma mistura homogênea onde os componentes estão quimicamente combinados.
c) Uma combinação física de duas ou mais substâncias, onde cada componente mantém suas propriedades individuais.
d) Uma mistura heterogênea onde os componentes estão uniformemente distribuídos.
e) Uma substância pura com propriedades variáveis.
10 – Qual das seguintes propriedades é considerada uma propriedade definida de uma substância pura?
a) Massa
b) Densidade
c) Cor
d) Volume
e) Temperatura de fusão.
11 – O que são propriedades invariáveis, segundo o texto?
a) Propriedades que variam dependendo da composição e proporções dos componentes em uma mistura.
b) Propriedades que não variam para uma substância pura sob condições específicas.
c) Propriedades que podem ser medidas com precisão.
d) Propriedades que não mudam independentemente das condições ou quantidade da substância.
e) Propriedades que mudam apenas para substâncias quimicamente combinadas.
.
12 – Por que o estudo das misturas é considerado um campo fascinante e complexo da química, segundo o texto?
a) Porque as misturas são simples de entender e prever.
b) Porque as misturas sempre apresentam propriedades invariáveis.
c) Porque as misturas não afetam as propriedades das substâncias individuais.
d) Porque as propriedades das misturas podem variar dependendo da composição e proporções dos componentes.
e) Porque as misturas são menos importantes do que as substâncias puras.
1-c, 2-e, 3-c, 4-d, 5-d, 6-d, 7-c, 8-c, 9-c, 10-e, 11-d, 12-d

