Sumário
ToggleIntrodução
Para você que está se preparando para o ENEM ou quaisquer outros vestibulares do Brasil, entender conceitos de química como a energia de ionização é fundamental, não só para acertar questões específicas, mas também para ter uma visão mais ampla da química dos elementos. Nesta aula, exploraremos profundamente o que é energia de ionização, como ela é medida e sua relação inversa com o raio atômico.
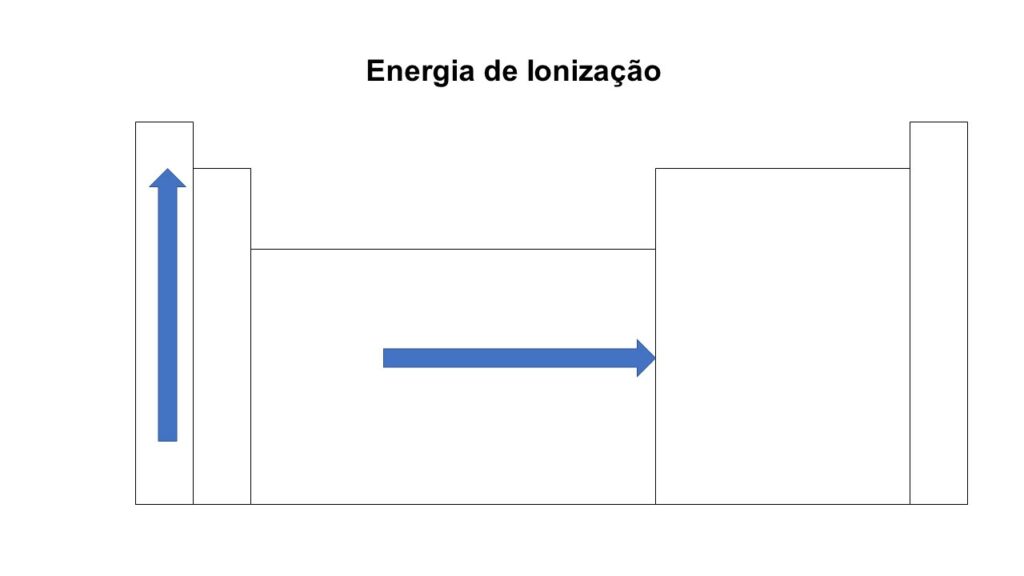
Definição e representação da energia de ionização
Precipuamente, a energia de ionização é a energia necessária para remover o elétron mais externo de um átomo isolado no estado gasoso (preste atenção aqui, o estado é gasoso). Fazendo uma analogia bem simples, imagine que você deseja comprar alguma coisa, para isso você precisará de dinheiro para retirar o item da loja. O dinheiro nesse exemplo é a energia de ativação. Essa propriedade é importante para compreender a reatividade dos elementos, bem como, sua tendência em formar íons. Assim, a energia de ionização é geralmente expressa em elétron-Volts (eV), podendo ser medida por técnicas como espectroscopia de fotoelétrons, que ilumina átomos com fótons e mede a energia necessária para liberar elétrons.
Exemplos
Fácil
O hidrogênio, com uma única energia de ionização de 13,6 eV, ilustra um caso simples de medição direta em laboratório.
Médio
Por exemplo, o magnésio, com uma primeira energia de ionização relativamente baixa, mostra um aumento significativo em sua segunda energia de ionização devido à remoção de um elétron de uma camada mais próxima ao núcleo.
Difícil
O ferro, um metal de transição, tem múltiplas energias de ionização que refletem a complexa estrutura eletrônica e, do mesmo modo, a estabilidade proporcionada pelos elétrons d.
Exercício prático:
Calcule a diferença entre a primeira e segunda energias de ionização para o alumínio usando dados experimentais e, então, discuta o que isso revela sobre a estrutura eletrônica do elemento. (Faça uma pesquisa desses valores)
Relação com o raio atômico
A energia de ionização, bem como, o raio atômico de um átomo têm uma relação inversa: geralmente, quanto maior o raio atômico, menor a energia de ionização. Isso ocorre porque elétrons mais distantes do núcleo são mais fáceis de remover porque não são atraídos tão fortemente por ele.
Exemplos
Fácil
Nos metais alcalinos, o aumento do raio atômico ao longo do grupo corresponde a uma diminuição na energia de ionização.
Médio
Nos halogênios, apesar de possuírem raios atômicos menores do que os gases nobres, têm energias de ionização mais altas devido à maior atração nuclear.
Difícil
Nos lantanídeos, o efeito de contração dos lantanídeos resulta em raios atômicos decrescentes, assim como, um aumento sutil na energia de ionização ao longo da série.
Exercício prático:
Analise a variação da energia de ionização para os elementos do segundo período, bem como, elabore uma justificativa baseada na variação do raio atômico.
Conclusão
Em suma, compreender a energia necessária para a ionização e sua relação com o raio atômico não só ajuda na resolução de questões de vestibulares, mas também no entendimento profundo das propriedades químicas dos elementos. Então, esta compreensão é essencial para qualquer estudante que aspire a excelência em provas de química e ciências naturais no ENEM e outros exames competitivos.
Questões objetivas de 1 a 4
Questão 1
Qual técnica é primariamente utilizada para medir a energia de ionização de um átomo?
A) Cromatografia
B) Espectroscopia de fotoelétrons
C) Espectroscopia de massa
D) Microscopia eletrônica
E) Ressonância magnética nuclear
Questão 2
Decerto, qual afirmação melhor explica o aumento na segunda energia de ionização do magnésio em comparação com a primeira?
A) Remoção de elétrons de uma camada eletrônica externa
B) Remoção de elétrons do mesmo subnível energético
C) Atração nuclear significativamente reduzida após a primeira ionização
D) Remoção de um elétron de uma camada mais próxima ao núcleo após a primeira ionização
E) Estabilidade dos elétrons “p” após a primeira ionização
Questão 3
Decerto, como a energia de ionização varia ao longo do grupo dos metais alcalinos na tabela periódica?
A) Aumenta com o aumento do número atômico
B) Diminui com o aumento do número atômico
C) Permanece constante
D) Varia aleatoriamente
E) Aumenta com a diminuição do raio atômico
Questão 4
Então, qual é o principal fator que explica o aumento da energia para a ionização nos lantanídeos devido ao efeito de contração dos lantanídeos?
A) Maior blindagem dos elétrons d
B) Diminuição do número de prótons
C) Aumento da atração nuclear efetiva
D) Redução dos elétrons de valência
E) Aumento do raio atômico
Questões objetivas de 5 a 8
Questão 5
Qual é o efeito da distância crescente entre o núcleo e o elétron mais externo sobre a energia de ionização?
A) Aumenta a energia
B) Diminui a energia
C) Não afeta a energia
D) Inverte a ordem de ionização
E) Estabiliza a energia
Questão 6
Por que os halogênios têm energias de ionização mais altas do que os gases nobres adjacentes, apesar de terem raios atômicos menores?
A) Menor número de elétrons
B) Maior estabilidade eletrônica
C) Maior atração nuclear
D) Menos camadas eletrônicas
E) Blindagem eletrônica mais eficaz
Questão 7
Então, qual fenômeno você esperaria observar na energia de ionização ao longo de um período da tabela periódica e por quê?
A) Diminuição devido à adição de elétrons
B) Aumento devido ao maior número de camadas eletrônicas
C) Aumento devido à maior atração nuclear sobre os elétrons mais externos
D) Diminuição devido à redução da blindagem eletrônica
E) Variação aleatória devido a mudanças isotópicas
Questão 8
Como a primeira e segunda energias de ionização do alumínio ilustram a estrutura eletrônica do átomo?
A) Primeira ionização é baixa devido à disponibilidade de elétrons “p”
B) Segunda ionização é alta devido à remoção de elétrons de uma camada interna
C) Primeira ionização é alta devido à estabilidade do subnível “p” completo
D) Ambas ionizações são baixas devido à baixa atração nuclear
E) A segunda ionização não mostra mudança significativa da primeira
Resposta: 1 -B, 2-D, 3-B, 4-C, 5-B, 6-C, 7-C, 8-B

