Sumário
ToggleIntrodução
No vasto campo da química moderna e da física atômica, a compreensão da Atomística Avançada com suas estruturas, bem como, seus conceitos sobre os átomos é importantíssimo para decifrar os mistérios da matéria e as interações complexas que ocorrem. Desde o original modelo atômico de Schrödinger – que propôs a noção de orbitais em vez de órbitas definidas – até a dinâmica complexa entre átomos e íons, os modelos atômicos têm sido utilizados para descobrir novas tecnologias e soluções em várias áreas científicas. Aqui, examinaremos as mudanças nos modelos atômicos, assim como, elas afetaram nossa compreensão dos elementos químicos e seus inúmeros fenômenos relacionados. Visando melhorar a sua preparação para os vestibulares mais renomados do nosso país preparamos esse conteúdo de Atomística Avançada.
1. O modelo atômico proposto por Schrödinger
O modelo atômico de Schrödinger, um marco na mecânica quântica, abandona a noção de órbitas definidas para os elétrons e adota o conceito de orbitais, as quais são regiões de espaço ao redor do núcleo onde a probabilidade de encontrar um elétron é maior. Para entender como os elétrons ajudam a formar ligações químicas, reatividade e configuração eletrônica nos átomos, este modelo é essencial. A base deste modelo é a teoria quântica, que mostra que os elétrons têm distribuições de probabilidade em vez de posições fixas. Isso altera nossa compreensão de fenômenos como absorção de luz e coloração de compostos.
2. A estrutura do átomo

A química moderna depende da compreensão de como um átomo é estruturado, sendo a sua estrutura dividida em núcleo e eletrosfera. O núcleo, pequeno e denso, contém prótons e nêutrons e representa quase toda a massa do átomo. A eletrosfera, composta por elétrons que orbitam o núcleo em diferentes níveis de energia, determina as propriedades físicas e químicas do material, incluindo a ionização e a capacidade de formar ligações. A estabilidade dos átomos e os atributos ópticos e magnéticos são afetados por essa estrutura.
3. Neutralidade elétrica do átomo
Não apenas na física, mas também na química, um princípio fundamental é a neutralidade elétrica de um átomo em seu estado fundamental. Um átomo neutro tem a mesma quantidade de prótons (com carga positiva) quanto de elétrons (com carga negativa). Este equilíbrio é basilar para a estabilidade dos átomos e afeta como eles interagem com campos elétricos externos e, do mesmo modo, entre si. Por isso, estudar temas como ligações covalentes, que ocorrem quando os átomos são unidos em moléculas estáveis por meio do compartilhamento de elétrons, é necessário ter uma compreensão deste equilíbrio.
4. O conceito de íon
Primeiramente, quando átomos ganham ou perdem elétrons, uma carga elétrica desbalanceada resulta na formação de íons. Este conceito é essencial para entender uma gama gigantesca de processos químicos, como a formação de sais em reações de neutralização, bem como, a combustão de materiais e como os eletrólitos funcionam em solução. A formação de íons é necessária para vários processos biológicos, como a transmissão de sinais nervosos, por exemplo. Nesses processos, íons específicos atravessam as membranas celulares e iniciam cadeias de eventos que resultam em ações celulares.
5. A relação entre átomos e íons
A mudança do estado energético de um elétron sem afetar o núcleo atômico é a principal característica da relação entre átomos e íons. Este conceito é fundamental para entender reações químicas, principalmente as que envolvem transferência de elétrons. Então, a capacidade de um átomo neutro de se transformar em um íon positivo ou negativo permite abordar questões como oxidação e redução, importantíssimos em processos industriais, biológicos e ambientais.
6. Representação química – atomística avançada
A representação química de átomos e íons é uma parte importante da química porque permite que as estruturas e configurações eletrônicas dos componentes sejam claramente comunicadas. Os símbolos elementares dos átomos são mostrados e, quando são neutros, não mostram nenhuma informação de carga. Por outro lado, os íons são representados pelo mesmo símbolo juntamente com uma carga positiva ou negativa, representando a perda ou ganho de elétrons. Certamente, para entender as reações químicas e os mecanismos de ação entre várias substâncias, essa notação é basilar. É fundamental para qualquer cientista ou estudante de ciências em geral, conseguir decifrar, assim como, utilizar essa simbologia, por permitir previsões de comportamentos químicos e compreensão de conceitos como estrutura molecular e valência.
7. Isótonos, isótopos e isóbaros
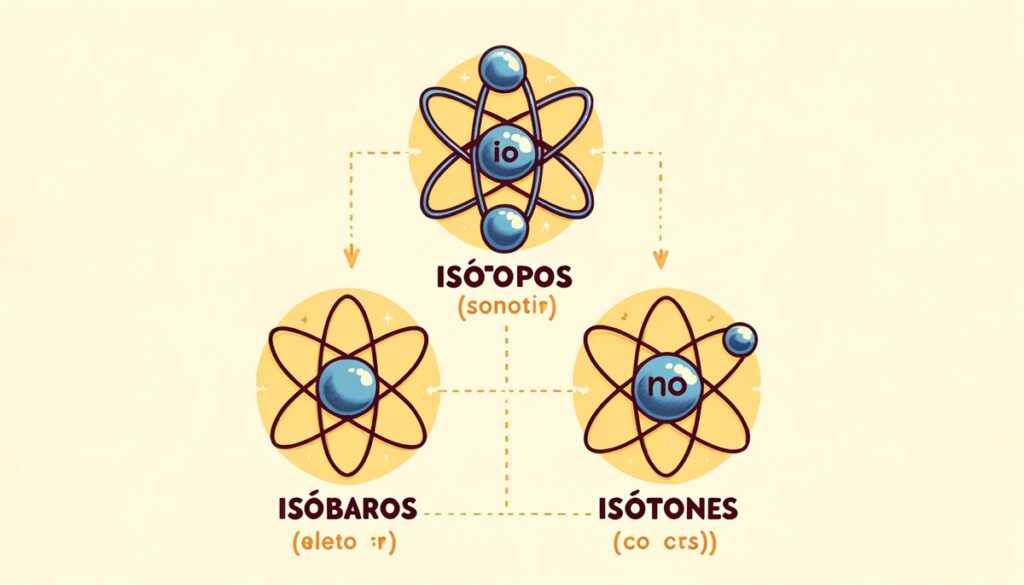
Isótopos são átomos de um mesmo elemento com diferentes números de nêutrons, porém, o número de prótons é o mesmo (até mesmo porque, se fossem diferentes, o elemento químico também seria diferente). Portanto, as técnicas de datação radiométrica e a radioatividade, que dependem da taxa de decaimento de isótopos específicos, dependem deste entendimento. Isóbaros, átomos com a mesma massa atômica, mas diferentes números de prótons, e isótonos, átomos com o mesmo número de nêutrons, mas diferentes números de prótons.
8. As espécies isoeletrônicas
Os íons ou moléculas que possuem a mesma quantidade de elétrons são conhecidos como espécies isoeletrônicas. Este conceito é possibilita um entendimento mais aprofundado na química, principalmente na compreensão das propriedades estruturais e reatividade de compostos. Por exemplo, o CO₂ e o N₂O são isoeletrônicos, o que os torna semelhantes em suas propriedades químicas e físicas. Entender e, do mesmo modo, reconhecer as espécies isoeletrônicas serve para prever comportamentos químicos e também é usado no design de fármacos, onde a similaridade eletrônica pode indicar potencial bioatividade.
9. A importância dos diferentes modelos atômicos
Sem dúvida, a ciência explica alguns fenômenos usando uma variedade de modelos atômicos. Então, Modelos como o de Bohr e o de partículas de Thomson, além do modelo de Schrödinger, oferecem uma visão distinta da estrutura e do comportamento dos átomos sob diferentes condições. Por isso, para interpretar corretamente os experimentos e fenômenos observados, é relevante saber quando e como aplicar cada um desses modelo. Essa flexibilidade dos modelos destaca a natureza evolutiva do conhecimento científico, assim como, mostra a complexidade dos mundos atômico e subatômico.

Exercícios objetivos de 1 a 5 – atomística avançada
1. No modelo atômico de Schrödinger, o que exatamente define um orbital?
A) Uma região de alta probabilidade de encontrar um elétron.
B) Uma trajetória fixa de um elétron ao redor do núcleo.
C) Um caminho determinado que um elétron segue.
D) Uma área de carga elétrica positiva no átomo.
2. Qual é a principal diferença entre o núcleo e a eletrosfera de um átomo?
A) O núcleo contém elétrons e a eletrosfera prótons.
B) O núcleo é negativamente carregado, enquanto a eletrosfera é positiva.
C) O núcleo contém prótons e nêutrons, e a eletrosfera elétrons.
D) A eletrosfera contém nêutrons e o núcleo não possui cargas.
3. O que garante a neutralidade elétrica de um átomo?
A) A presença de nêutrons no núcleo.
B) O equilíbrio entre o número de prótons e elétrons.
C) A transferência constante de elétrons.
D) A imobilidade dos elétrons na eletrosfera.
4. Um íon é formado quando um átomo:
A) Ganha prótons.
B) Perde ou ganha nêutrons.
C) Perde ou ganha elétrons.
D) Troca prótons por elétrons.
5. Qual das seguintes afirmações sobre a relação entre átomos e íons é correta?
A) Um íon tem um núcleo diferente de seu átomo original.
B) Ao tornar-se um íon, o número de prótons no núcleo de um átomo pode mudar.
C) Ao tornar-se um íon, o átomo não altera seu núcleo, apenas a eletrosfera.
D) Os íons formam-se exclusivamente por ganho de prótons.
Exercícios objetivos de 6 a 10 – atomística avançada
6. Como são representados quimicamente os íons?
A) Pelo número de nêutrons e a carga.
B) Pelo símbolo do elemento e uma carga positiva ou negativa.
C) Somente pelo símbolo do elemento, pois todos os íons são neutros.
D) Pelo número de prótons sem indicação de carga.
7. Isótopos são átomos que diferem em:
A) Número de prótons.
B) Número de elétrons.
C) Número de nêutrons.
D) Carga elétrica total.
8. Espécies isoeletrônicas são aquelas que possuem:
A) O mesmo número de prótons.
B) O mesmo número de nêutrons.
C) O mesmo número de elétrons.
D) A mesma massa atômica.
9. Qual o propósito de utilizar diferentes modelos atômicos na ciência?
A) Demonstrar que os modelos mais antigos são incorretos.
B) Aplicar um único modelo em todos os contextos científicos.
C) Escolher o modelo que melhor explica fenômenos específicos.
D) Simplificar o ensino de química sem detalhar diferenças.
10. Qual característica é compartilhada por isóbaros?
A) Mesmo número de prótons.
B) Mesma carga elétrica.
C) Mesma massa atômica.
D) Mesmo número de elétrons.
Respostas Atomística Avançada: 1-A, 2-C, 3-B, 4-C, 5-C, 6-B, 7-C, 8-C, 9-C, 10-C

