Sumário
ToggleIntrodução
Primeiramente, ao se preparar para o ENEM ou outros vestibulares, compreender conceitos fundamentais de química é essencial. Um desses conceitos é a afinidade eletrônica, que desempenha um papel importante no entendimento das reações químicas e, do mesmo modo, das propriedades dos elementos. Abordaremos em profundidade o que é afinidade eletrônica, como ela é medida, bem como, sua variação na tabela periódica.
Definição
Precipuamente, a afinidade por elétrons refere-se à quantidade de energia liberada quando um átomo neutro no estado gasoso ganha um elétron para formar um íon negativo. Aliás, este processo é extremamente importante para o entendimento de como os átomos interagem em várias reações químicas. A energia liberada durante este processo é um indicativo direto da tendência de um átomo em atrair elétrons.
Exemplos
Fácil: então, o cloro, conhecido por sua alta afinidade eletrônica, libera uma quantidade de energia significativa ao ganhar um elétron, formando Cl⁻.
Médio: assim, o nitrogênio, ao ganhar um elétron para formar N⁻, mostra uma afinidade eletrônica moderada, refletindo sua configuração eletrônica mais estável que outros elementos do grupo.
Difícil: por exemplo, o neônio, um gás nobre, tem uma afinidade por elétrons praticamente nula ou até positiva, o que significa que ele realmente requer energia para ganhar um elétron, devido à estabilidade de sua configuração eletrônica. Isso implica que os gases nobres podem reagir, assim como, formar compostos, dependendo exclusivamente da energia empregada para tal.
Exercício Prático: Calcule a variação da energia liberada com a adição de elétrons ao oxigênio, bem como, ao enxofre e discuta as implicações para a reatividade desses elementos. (Procure os valores em livros e sites)
Variação da afinidade eletrônica
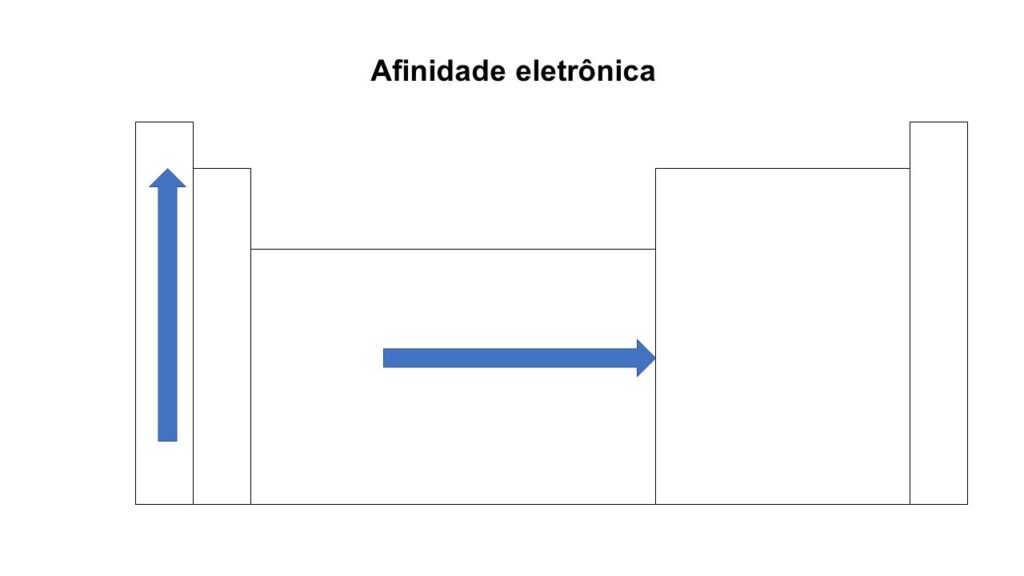
A afinidade eletrônica varia consideravelmente entre os diferentes elementos e, suas posições na tabela periódica. Nesse sentido, ela aumenta ao longo de um período (da esquerda para a direita) devido ao aumento da carga nuclear efetiva que atrai mais fortemente os elétrons adicionais e quando considerado o grupo, ela aumenta de baixo para cima.
Exemplos
Fácil: os halogênios, situados no penúltimo grupo da tabela periódica, têm alta afinidade eletrônica, por estarem a apenas um elétron de completar sua camada de valência.
Médio: os metais alcalinos, no começo de um período, têm baixa afinidade eletrônica porque seu elétron mais externo está relativamente distante do núcleo. O que diminui a influência do núcleo sobre o elétron mais distante.
Difícil: por exemplo, os elementos de transição apresentam uma variação complexa em sua afinidade eletrônica devido à ocupação dos subníveis d, influenciando diferentemente sua tendência em ganhar elétrons. Devido ao efeito de blindagem dos orbitais “d” e “f”
Exercício Prático: Analise a tendência da afinidade nos elementos do segundo período da tabela periódica e relacione com a estrutura eletrônica.
Conclusão
Em suma, a afinidade eletrônica é um conceito fascinante e essencial para os estudantes que estão se preparando para o vestibular e o ENEM, por oferecer percepções profundas sobre a natureza reativa dos elementos. Entender como diferentes elementos ganham elétrons e liberam energia ajuda não só na resolução de questões específicas, mas também em uma compreensão mais ampla das propriedades químicas fundamentais.
Questões objetivas de 1 a 4
1 – Qual processo descreve melhor a afinidade eletrônica?
a) Energia absorvida quando um íon positivo perde um elétron.
b) Energia liberada quando um átomo neutro ganha um elétron.
c) Energia necessária para quebrar uma ligação iônica.
d) Energia necessária para remover um elétron de um íon negativo.
e) Energia liberada durante a formação de uma ligação covalente.
2- Como a afinidade eletrônica varia ao longo de um período na tabela periódica?
a) Diminui de esquerda para direita.
b) Aumenta de esquerda para direita.
c) Permanece constante.
d) Aumenta de baixo para cima.
e) Não tem padrão definido.
3 – Qual elemento é mais provável que tenha uma elétron afinidade negativa?
a) Cloro
b) Sódio
c) Oxigênio
d) Neônio
e) Carbono
4 – Enfim, qual é o efeito de blindagem relacionado à afinidade eletrônica em elementos de transição?
a) Aumenta a afinidade.
b) Diminui a afinidade.
c) Não afeta a afinidade.
d) Torna a afinidade mais previsível.
e) Reduz o efeito da carga nuclear efetiva.
Questões objetivas de 5 a 8
5 – Qual das seguintes afirmações é verdadeira sobre a afinidade eletrônica dos halogênios?
a) É mais baixa que a dos gases nobres.
b) É negativa para todos os halogênios.
c) Aumenta com a adição de elétrons.
d) É maior devido à proximidade de completar sua camada de valência.
e) Diminui significativamente no grupo.
6 – Qual fator contribui para a baixa afinidade eletrônica dos metais alcalinos?
a) Alta reatividade com a água.
b) Elétrons de valência mais próximos ao núcleo.
c) Elétrons de valência distantes do núcleo.
d) Alta condutividade elétrica.
e) Baixa eletronegatividade.
7 – O que a medida da afinidade eletrônica indica sobre um elemento?
a) Seu potencial de ionização.
b) Sua capacidade de conduzir eletricidade.
c) Sua tendência em atrair elétrons.
d) Sua capacidade de formar moléculas diatômicas.
e) Seu estado físico em condições padrão.
8 – Como a afinidade eletrônica do oxigênio compara-se com a do enxofre?
a) Oxigênio tem maior afinidade.
b) Enxofre tem maior afinidade.
c) Ambos têm afinidades semelhantes.
d) Oxigênio tem afinidade negativa.
e) Enxofre tem afinidade negativa.
Respostas: 1-B, 2-B, 3-D, 4-E, 5-D, 6-C, 7-C, 8-A

